Scheikunde is niet moeilijk
 Als je logisch kunt redeneren en van puzzelen houdt, is scheikunde niet moeilijk. Maar toch vinden veel leerlingen scheikunde lastig. Hoe komt dat?
Als je logisch kunt redeneren en van puzzelen houdt, is scheikunde niet moeilijk. Maar toch vinden veel leerlingen scheikunde lastig. Hoe komt dat?
In het begin is scheikunde erg abstract en ook wel saai. Je praat over deeltjes die je niet kunt zien, laat staan dat je ze kunt vastpakken: atomen, protonen, neutronen, electronen, moleculen en ionen.
En dan ook nog al die symbolen: Na, H, O, Pb, Cl en noem maar op. Je hebt geen flauw idee hoe ze dat allemaal ontdekt hebben en waar al die informatie goed voor is.
Dit is de zure appel waar je doorheen moet bijten, want pas enkele lessen later wordt scheikunde leuk en begrijp je op een gegeven moment waarom kaarsvet bij 69 °C smelt en slecht oplost in water, terwijl keukenzout pas bij 800 °C smelt en juist wel goed oplost in water. Waarom een oplossing van keukenzout in water electrische stroom goed geleidt en een oplossing van suiker in water niet. Hoe een batterij werkt en waarom sommige batterijen oplaadbaar zijn en andere niet.
Voordat je echt met scheikunde aan de slag kunt, heb je eerst de nodige basiskennis nodig en moet je de belangrijkste afspraken kennen, waaraan alle scheikundigen over de hele wereld zich houden. Die afspraken zijn meestal erg logisch, maar niet altijd. Sommige afspraken, gewoontes en naamgevingen zijn historisch gegroeid, die moet je dan simpelweg uit je hoofd leren. Dat komt omdat het bedrijven van scheikunde een oude bezigheid is, die vroeger met veel magie omgeven was. Het vak scheikunde is ouder dan de moderne mens.
Gelukkig is er het Binas-Tabellenboek, waarin je veel feitenmateriaal en gegevens kunt opzoeken. Als je de Binas regelmatig doorbladert, gaat er een wereld voor je open.
Menig scholier van het middelbaar of voorgezet onderwijs kijkt, als het om scheikunde gaat, vol huivering terug op het onderwerp "de mol", een begrip dat echter onmisbaar is en daarom altijd ter sprake komt. Scheikunde is onmogelijk zonder "de mol".
"De mol" is een eenvoudig begrip, dat toch voor velen het eerste grote struikelblok is en waarbij in de les ongemerkt de nodige slachtoffers vallen. In de scheikunde op middelbare-schoolniveau komt geen moeilijke wiskunde voor, daar kan het niet aan liggen.
Onderschat de docent misschien de kracht van het onderhuidse 'stigma' dat op "de mol" rust ? Als iedereen zegt dat het zo moeilijk is, dan zal het ook wel moeilijk zijn en heeft het geen zin om de moeite te nemen het goed te begrijpen. En vervolgens wordt aan de volgende generatie scholieren bevestigend doorgegeven dat "de mol" inderdaad erg moeilijk is... een 'self-fulfilling prophecy' dus...
Ben je nu nieuwsgierig naar wat "de mol" precies is ? Zo ja, klik dan hier.
Kortom, scheikunde is een interessant vak, waaraan je veel plezier aan kunt beleven en dat goed is voor de training van je logisch denkvermogen.
En niet te vergeten: het is een uitstekende basis voor je verdere professionele carrière.
Waar komt de naam scheikunde vandaan?
In vroegere tijden, toen de mens nog vooral aan het ontdekken was waaruit de verschillende stoffen om ons heen bestaan, hield men zich veel bezig met het scheiden van mengsels. Dit werd scheidingskunde en later scheikunde genoemd.
Ofschoon het goed kunnen scheiden van stoffen nog steeds belangrijk is, houden scheikundigen zich nu meestal bezig met het mengen van stoffen en het maken van nieuwe stoffen. Toch is de naam scheikunde in het Nederlands taalgebruik gebleven.
Praktijk:
Hoe ontdekt men in de wetenschap nieuwe feiten? Kijk eens naar dit eenvoudige voorbeeld.
Heb je een opmerking over dit artikel, of wil je reageren, ga dan naar het forum.
De Beruchte Mol
 Als een bierliefhebber boodschappen gaat doen, zal hij (of zij?) niet zeggen: "Ik ga vierentwintig flesjes bier kopen". Eigenlijk een slecht gekozen voorbeeld als je nog geen zestien bent, maar je weet vast dat hij zal zeggen: "Ik ga een kratje bier kopen".
Als een bierliefhebber boodschappen gaat doen, zal hij (of zij?) niet zeggen: "Ik ga vierentwintig flesjes bier kopen". Eigenlijk een slecht gekozen voorbeeld als je nog geen zestien bent, maar je weet vast dat hij zal zeggen: "Ik ga een kratje bier kopen".
Zijn vrouw zal niet zeggen dat ze tien schoenen heeft, maar dat ze vijf paar schoenen bezit.
Met een "kratje" bedoelt men dan 24 en met een "paar" 2.
Een ouderwetser voorbeeld is het woord "dozijn" dat altijd een aantal gelijk aan twaalf is.
De scheikundige mol is een handige maat voor de hoeveelheid van een stof.
Scheikundigen werken namelijk met reacties en reactievergelijkingen. In die reactievergelijkingen staat in welke aantal-verhoudingen deeltjes met elkaar reageren. Daarom is het handig om het aantal deeltjes wat je hebt te kunnen 'tellen'.
Voorbeeld: De reactievergelijking voor de volledige verbranding van methaan (aardgas) is als volgt:
CH4 + 2 O2 --> CO2 + 2 H2O
De reactievergelijking zegt WEL: 1 deeltje (molecuul) CH4 reageert met 2 deeltjes (moleculen) O2 en dan ontstaat er 1 deeltje (molecuul) CO2 en 2 deeltjes (moleculen) H2O.
De reactievergelijking zegt NIET: 1 gram CH4 reageert met 2 gram O2 ... enzovoorts.
De reactievergelijking geeft aantallen-verhoudingen, niet massa-verhoudingen! Daarom willen scheikundigen graag het aantal deeltjes kunnen tellen.
De scheikundige mol is een begrip dat een zeker aantal deeltjes aangeeft. Net als een "dozijn" (12 stuks) of een kratje bier (24 flesjes).
Je kunt dus van alles 1 mol hebben, maar het is wel een beetje veel: het aantal is ongeveer een 6 met 23 nullen er achter. Dit komt omdat scheikundige deeltjes heel erg klein en licht zijn: als je een beetje stof hebt, bijvoorbeeld één druppeltje water, dan heb je toch al een aantal deeltjes met 21 cijfers vóór de komma.
Hieronder wordt de mol uitgelegd aan de hand van enkele eenvoudige voorbeelden.
Lees deze aandachtig door en probeer ze echt te begrijpen. Dat zal je helpen om je eventuele problemen met de mol voor eens en altijd de wereld uit te helpen. Want problemen met de mol zijn echt niet nodig.
Onthoud vooral één ding: als je het in de scheikunde over de mol hebt, dan bedoel je altijd een AANTAL dat je zou kunnen tellen, dus niet een massa (bv gram), inhoud (bv liter) of iets anders.
VOORBEELD 1
Stel: 1 knikker weegt 6,84 gram
Stel: 1 koffieboontje weegt 0,953 gram
• Als we 1000 knikkers nemen, wegen deze samen: 1000 * 6,84 gram = 6840 gram, oftewel 6,84 kilo.
• Als we 1000 koffieboontjes nemen, wegen deze samen: 1000 * 0,953 gram = 953 gram, oftewel 0,953 kilo.
Dus als we 1000 voorwerpen nemen, dan is het getal van de totale massa van die voorwerpen in kilo’s gelijk aan de massa van één voorwerp in grammen.
Waarschijnlijk vind je dit logisch, want 1000 keer één gram wordt tenslotte precies één kilo. Het aantal 1000 is dus niet toevallig, want in één kilo passen precies 1000 grammen. Met 999 of 1001 stuks klopt het al niet meer!
Het aantal 1000 noemen we hier voor het gemak “een duiz”.
Als één knikker 6,86 gram weegt, dan weegt één "duiz" knikkers 6,86 kilo.
Of omgekeerd: als één knikker 6,86 gram weegt, dan zit er in 6,86 kilo van deze knikkers één "duiz" (oftewel 1000) knikkers.
Conclusie
Als we één "duiz" (dus 1000) voorwerpen nemen, dan is de totale massa van die voorwerpen in kilo’s getalsmatig gelijk aan de massa van één voorwerp in grammen.
Het maakt niet uit wat het voorwerp is. Als één auto 1,1 miljoen gram (1100 kg) weegt, dan weegt 1 "duiz" van diezelfde auto 1,1 miljoen kilo. Oftewel hetzelfde getal (1,1 miljoen) maar grammen worden kilo's.
VOORBEELD 2
(Het ECHTE werk !)
Opmerking vooraf: waar het bij dit voorbeeld vooral om gaat, is dat je inziet dat het eigenlijk niet anders is dan het eerste voorbeeld; alleen nu met andere eenheden en andere getallen.
Eén waterstofatoom weegt 1,0 u en één zuurstofatoom weegt 16,0 u (Binas tabel 99).
Eén watermolecuul (H2O) weegt dan: 2 * 1,0 u + 1 * 16,0 u = 18,0 u (18,0 “uutjes”)
• Als we 6,0221 * 10 23 watermoleculen nemen, wegen deze samen 6,0221 * 10 23 * 18,0 u = 1,0840 * 10 25 u
Oftewel in grammen uitgedrukt: 1,0840 * 10 25 u * 1,66054 * 10 -24 gram per u = 18,0 gram.
(De massa van 1 u in kilo staat in Binas tabel 7 en is gelijk aan 1,66054 * 10 -24 gram)
Dus als we 6,0221 * 10 23 watermoleculen nemen, dan is het getal van de totale massa van die watermoleculen in grammen gelijk aan de massa van één molecuul in u.
Waarschijnlijk vind je dit niet meteen logisch, omdat het zulke rare getallen zijn, maar toch is het aantal 6,0221 * 10 23 niet toevallig, want in één gram passen precies 6,0221 * 10 23 "uutjes", probeer dit maar eens na te gaan.
Het aantal 6,0221 * 10 23 noemen scheikundigen “een mol”.
Als één molecuul 18,0 u weegt, dan weegt één "mol" moleculen 18,0 gram.
Of omgekeerd: als één molecuul 18,0 u weegt, dan zit er in 18,0 gram van deze moleculen één "mol" (oftewel 6,0221 * 10 23) moleculen. Zo kunnen scheikundigen het aantal moleculen in een hoeveelheid stof 'tellen'.
Conclusie
Als we een aantal moleculen nemen gelijk aan “een mol”, dan is de totale massa van die moleculen in grammen getalsmatig gelijk aan de massa van één molecuul in u.
Dit voorbeeld is niet anders dan voorbeeld 1. Leg de twee voorbeelden maar eens naast elkaar.
De “voorwerpen” uit voorbeeld 2 zijn ook voorwerpen, alleen noemen we ze hier moleculen.
DEFINITIE en TIPS
-
Een aantal voorwerpen dat gelijk is aan de "constante van Avogadro" (6,0221 * 10 23) noemen we één mol.
Het is eenzelfde soort woord als een DOZIJN. Hiermee wordt namelijk ook een aantal voorwerpen bedoeld (12 stuks), alleen veel minder dan één mol.
-
Als we een aantal moleculen nemen gelijk aan de “Constante van Avogadro”, één mol dus, dan is de totale massa van die moleculen in grammen getalsmatig gelijk aan de massa van één molecuul in u.
Dit geldt voor elk molecuul, niet alleen voor het watermolecuul !
Zo is de massa van één molecuul koolstofdioxide (CO2): 1 * 12,0 + 2 * 16,0 = 44,0 u, dus één mol koolstofdioxide heeft een massa van 44,0 gram en in die hoeveelheid zitten dan 6,0221 * 10 23 koolstofdioxidemoleculen.
-
Je kunt met de mol ook het aantal deeltjes (moleculen) uitrekenen, dat in een bepaalde hoeveelheid stof zit. Je moet dan wel de massa van één deeltje (molecuul) weten. Die bereken je aan de hand van de molecuulformule en de atoommassa's uit Binas (bv tabel 99).
Voorbeeld: 100 gram koolstofdioxide (CO2).
Eén mol koolstofdioxide heeft een massa van 44,0 gram (zie vorige berekening).
100 gram koolstofdioxide is dus 100 / 44,0 = 2,27 mol. Daarin zitten dan 2,27 * 6,0221 * 10 23 = 1,37 * 10 24 koolstofdioxide-moleculen.
-
Je mag in een opgave het woord “mol” altijd door “dozijn” vervangen. De zin moet dan taalkundig nog steeds kloppen.
Alleen moet je wel onthouden, dat de uitkomst van de som dan niet meer klopt, omdat een dozijn natuurlijk een ander aantal is dan een mol.
-
Kun je ook 1 mol knikkers hebben? Ja dat kan!
Dat zijn er wel erg veel, namelijk 6,0221 * 10 23, dus 602 210 000 000 000 000 000 000. Er zijn niet zoveel knikkers op de hele wereld, maar anders zou het echt kunnen !
-
Vermeld in de tussenstappen van je berekeningen de eenheden waarin je op dat moment aan het rekenen bent.
Dan zie je namelijk waarmee je bezig bent, plus je hebt een extra mogelijkheid om je uitkomst te controleren.
Zo moet bijvoorbeeld een berekening "u" x "gram / u" (zie boven) een uitkomst in "gram" opleveren, want de "u"-s in teller en noemer vallen tegen elkaar weg.
VRAGEN
-
Hoeveel weegt 1 dozijn knikkers als één knikker 6,84 gram weegt ?
-
Hoeveel zou 1 mol knikkers dan wegen ? Let goed op wat je precies berekent en schrijf de eenheden waarin je rekent er steeds bij, dat helpt namelijk.
-
Ga na of het aantal moleculen dat in de "Prijsknaller" bovenaan de pagina wordt genoemd klopt. In het flesje zit 0,5 L water.
WEETJES
-
De naam Constante van Avogadro (vroeger meestal het getal van Avogadro genoemd) komt natuurlijk niet zomaar uit de lucht vallen. Hij is genoemd naar de Italiaanse wetenschapper Amedeo Avogadro die de mol als het ware ontdekt heeft.
-
Het Engelse woord voor "mol" is "mole". In het Duits "das Mol" en in het Frans "la mole".
-
De constante van Avogadro 6,0221 * 1023 is zo groot, dat je je daarvan geen voorstelling kunt vormen. Het is zo snel opgeschreven, maar hoe groot is dit getal eigenlijk?
Stel je hebt 1 mol dobbelstenen en elke dobbelsteen heeft een volume van 1 cm3 (oftewel één duizendste liter, 1 mL).
Als je deze hoeveelheid dobbelstenen gelijkmatig zou verdelen over de hele wereld, dus ook over de zeeën, hoe dik zou dan deze laag dobbelstenen worden?
Met het gegeven dat één dobbelsteen een volume heeft van 1 cm3, weten we het totale volume van 1 mol dobbelstenen, dat is namelijk 6,0221 * 1023 keer 1 cm3. Als we de aarde als een ideale bol beschouwen, met een omtrek bij de evenaar van 40 000 km, dan kunnen we de dikte van de laag dobbelstenen berekenen.
De laag zal ongeveer 1,2 kilometer dik zijn, dat is bijna tot aan de wolken !
Realiseer je dat het aantal dobbelstenen in deze dikke laag over de hele wereld net zo groot is als het aantal watermoleculen in slechts 18 mL water (ongeveer een eierdopje vol). Indrukwekkend toch ?
Heb je een opmerking over dit artikel, of wil je reageren, ga dan naar het forum.
POLAIR en APOLAIR - HYDROFIEL en HYDROFOOB
Klik op de plaatjes voor een vergrote weergave.
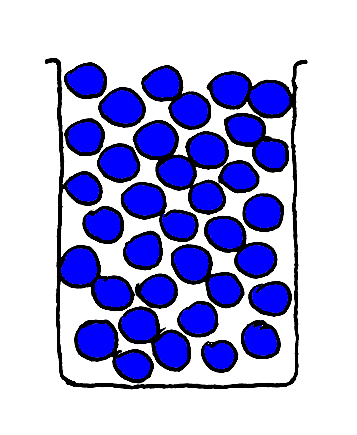
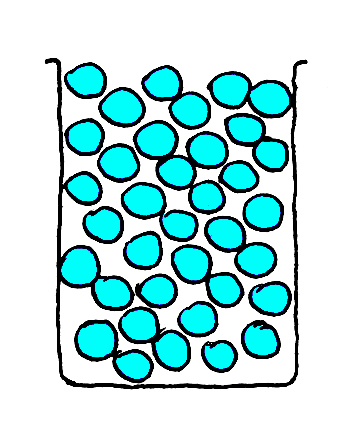
Ik heb vier bekerglazen met knikkers.
Twee bekerglazen met glazen knikkers, donkerblauw en lichtblauw (Fig. 1 en 2).
 |
 |
|
Fig. 1
|
Fig. 2
|
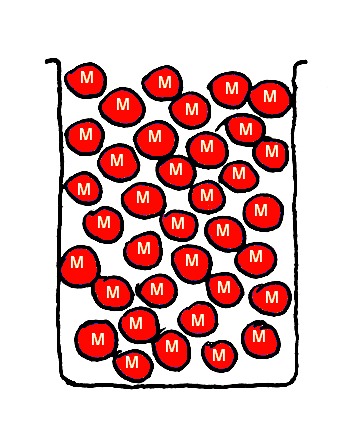
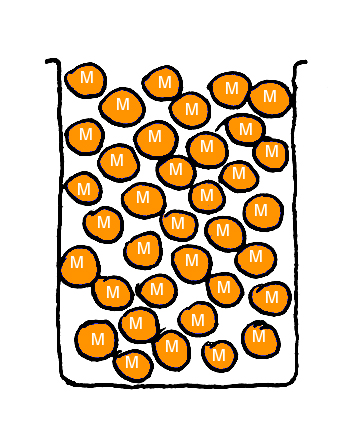
En twee bekerglazen met knikkers die magnetisch zijn, rood en oranje (Fig. 3 en 4).
 |
 |
|
Fig. 3
|
Fig. 4
|
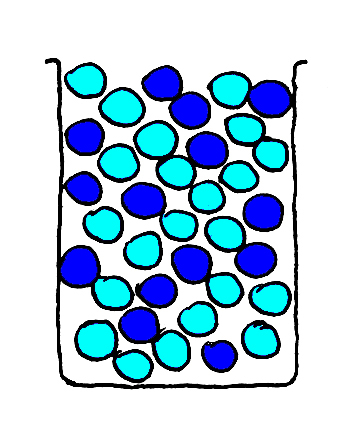
Ik breng een mengsel van de glazen knikkers, donkerblauw en lichtblauw, in één bekerglas en schud ze goed.
De glazen knikkers zullen in het mengsel willekeurig verdeeld zijn, want de ene glazen knikker heeft geen voorkeur voor de ander, zie Fig. 5.
 |
|
Fig. 5
|
CONCLUSIE: Glazen knikkers mengen onderling goed !
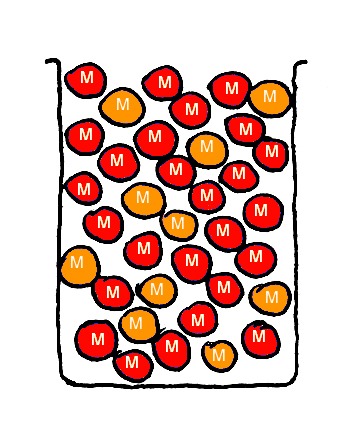
Nu breng ik een mengsel van de magnetische knikkers, rood en oranje, in één bekerglas en schud ze goed.
Ook nu zullen de knikkers in het mengsel willekeurig verdeeld zijn, want alle knikkers zijn weliswaar magnetisch, maar het maakt hen niet uit aan welke kleur ze ‘vastgeplakt’ zitten. Zie Fig. 6.
 |
|
Fig. 6
|
CONCLUSIE: Magnetische knikkers mengen onderling goed !
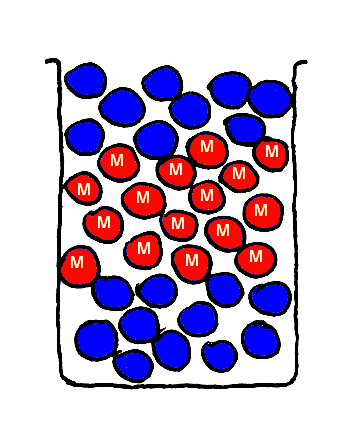
Nu breng ik een mengsel van blauwe (glazen) knikkers en rode (magnetische) knikkers bij elkaar en schud dit goed.
De magnetische knikkers zullen bij voorkeur aan elkaar ‘vastplakken’ en zo de blauwe knikkers verdrijven. De magnetische knikkers zullen op een ‘hoopje’ aan elkaar vastgeplakt zitten, de blauwe knikkers vullen de overgebleven ruimte, zie Fig. 7.
 |
|
Fig. 7
|
Eigenlijk zijn er in Fig. 7 dus twee blauwe lagen en één rode laag ontstaan.
CONCLUSIE: Glazen en magnetische knikkers mengen onderling niet goed !
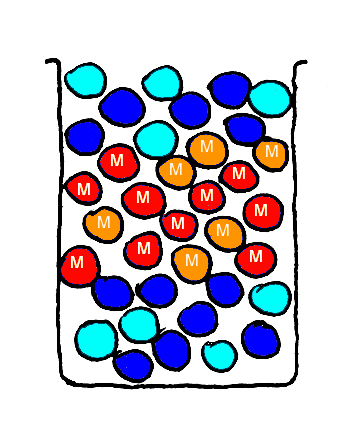
Tenslotte maak ik een mengsel van alle soorten knikkers en schud dit goed.
Het resultaat staat in Fig. 8.
 |
|
Fig. 8
|
Alle glazen knikkers mengen onderling en alle magnetische knikkers mengen onderling.
De glazen knikkers mengen echter niet met de magnetische knikkers.
Nu vertaald naar heuse moleculen
POLAIRE moleculen (deze zijn aan éne kant een beetje elektrisch + (plus) geladen (een scheikundige schrijft dan δ+ , spreek uit als "delta plus") en aan de andere kant een beetje elektrisch - (min) geladen (δ- spreek uit als "delta min") en daardoor trekken ze elkaar onderling aan, alsof het magnetische knikkers zijn.
Niet-polaire (APOLAIRE) moleculen (deze hebben geen δ+ en een δ- kant) trekken elkaar onderling nauwelijks aan, alsof het glazen knikkers zijn.
- POLAIRE moleculen mengen onderling
- APOLAIRE moleculen mengen onderling.
- POLAIRE moleculen mengen niet met APOLAIRE moleculen.
Het watermolecuul (H2O) is polair, dat hebben wetenschappers vastgesteld.
Andere polaire moleculen zullen dus goed met water mengen, oftewel: ze lossen op in water.
Apolaire moleculen lossen niet (of althans zeer slecht) op in water.
- Moleculen die graag in water willen oplossen (en dus polair zijn), noemt men hydrofiel (betekent letterlijk “houdt van water”).
- Moleculen die niet graag in water oplossen omdat ze apolair zijn, noemt men hydrofoob (betekent letterlijk “is bang van water”).
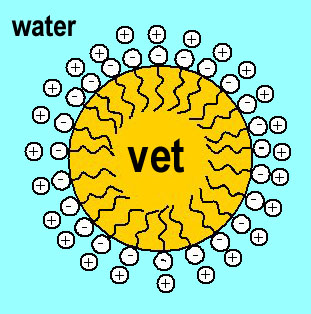 Sommige grote moleculen, zoals zeepmoleculen, zijn aan één kant hydrofiel (zij hebben een 'hydrofiele kop') en de rest van het molecuul is hydrofoob (een 'hydrofobe staart'). De kop van het molecuul zal dus graag in water zijn, terwijl de staart liever in vet (een hydrofobe stof) zit. Daarom kun je vette handen met water en zeep schoon krijgen en niet met water alleen, want vet (hydrofoob) lost niet goed op in water (hydrofiel). Klik op het plaatje voor een vergrote weergave van hoe een zeepmolecuul dat doet. De plus- en min-bolletjes in het plaatje stellen de hydrofiele kopjes van het zeepmolecuul voor.
Sommige grote moleculen, zoals zeepmoleculen, zijn aan één kant hydrofiel (zij hebben een 'hydrofiele kop') en de rest van het molecuul is hydrofoob (een 'hydrofobe staart'). De kop van het molecuul zal dus graag in water zijn, terwijl de staart liever in vet (een hydrofobe stof) zit. Daarom kun je vette handen met water en zeep schoon krijgen en niet met water alleen, want vet (hydrofoob) lost niet goed op in water (hydrofiel). Klik op het plaatje voor een vergrote weergave van hoe een zeepmolecuul dat doet. De plus- en min-bolletjes in het plaatje stellen de hydrofiele kopjes van het zeepmolecuul voor.
Emulsies
Een emulsie is een fijne verdeling van een vloeistof in een andere vloeistof. Het is een troebel mengsel en geen oplossing (klik hier voor uitleg over het verschil tussen een mengsel en een oplossing).
Voorbeelden: melk (vetbolletjes in water), mayonaise (fijn verdeelde oliedruppeltjes in water/azijn).
Je kunt een emulsie alleen maken van twee vloeistoffen die niet in elkaar oplossen, dus alleen van een combinatie van een hydrofiele vloeistof (bv water) en een hydrofobe vloeistof (bv olie).
Om ervoor te zorgen dat de olie-bolletjes niet aan elkaar gaan plakken en daardoor een grotere olie-laag vormen (zoals in fig. 7), heb je een derde stof nodig die dit voorkomt en daardoor de kleine olie-bolletjes stabiel maakt.
Zo een stof noem je een emulgator (letterlijk: emulsie-maker) en die werkt scheikundig gezien hetzelfde als zeep (zie hierboven). In mayonaise gebruik je een eierdooier. Hierin zit de stof lecithine, die als emulgator werkt.
Als je op de verpakking van levensmiddelen kijkt, zie je dat lecithine vaak in voedingsmiddelen wordt gebruikt, waarbij het kan worden vermeld met een E-nummer: E322.
Een aardig weetje...
Je kent vast wel peper, zwarte of witte. Dit is een specerij die een pittige - zeg maar 'hete' - smaak aan onze gerechten geeft. Ook met de bekende rode Spaanse peper zijn we in Nederland meestal wat voorzichtig, denk maar aan sambal.
De stoffen die deze producten zo 'heet' doen smaken zijn peperine (in zwarte of witte peper) en capsaïcine (in Spaanse peper). Deze beide stoffen zijn hydrofoob: ze lossen slecht op in water.
Wat doe je als je per ongeluk een te hete hap (dwz te heet gekruid) in je mond hebt? Je bent geneigd om water te drinken, maar dit helpt dus niet want de 'hete' stoffen lossen niet op in water. Je kunt beter iets drinken dat een beetje vet (hydrofoob) bevat, bijvoorbeeld melk!!
Heb je een opmerking over dit artikel, of wil je reageren, ga dan naar het forum.
![]() Opmerking, suggestie of vraag over deze pagina?
Opmerking, suggestie of vraag over deze pagina?![]() Hulp bij huiswerk, practica en andere vragen
Hulp bij huiswerk, practica en andere vragen![]() Oefenmateriaal
Oefenmateriaal![]() Scheikunde in de praktijk
Scheikunde in de praktijk 

![]() Bijzonder...
Bijzonder... 



 Als je logisch kunt redeneren en van puzzelen houdt, is scheikunde niet moeilijk. Maar toch vinden veel leerlingen scheikunde lastig. Hoe komt dat?
Als je logisch kunt redeneren en van puzzelen houdt, is scheikunde niet moeilijk. Maar toch vinden veel leerlingen scheikunde lastig. Hoe komt dat?








